- Accueil ›
- Thérapeutique ›
- Vigilances ›
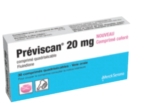
- Préviscan poussé vers la sortie
Préviscan poussé vers la sortie
Depuis le 1er décembre, l’Agence nationale de sécurité du médicament (ANSM) a décidé de restreindre les indications de la fluindione (Préviscan), en raison d’effets indésirables immunoallergiques tels que : atteintes rénales tubulo-interstitielles, hépatiques ou hématologiques, ou encore atteintes cutanées de type DRESS (éruption cutanée avec fièvre et hyperéosinophilie). Ces effets indésirables survenant le plus souvent au cours des six premiers mois de prise, la prescription de Préviscan en initiation de traitement n’est désormais plus autorisée. Une décision qui, après plusieurs alertes lancées en 2017, signe l’arrêt de mort à plus ou moins long terme du comprimé rose quadrisécable. Les praticiens devront se tourner vers un AVK coumarinique (warfarine/ Coumadine, acenocoumarol/ Sintrom, MiniSintrom) ou vers une autre classe d’anticoagulant. Seul le renouvellement de Préviscan reste possible pour les patients équilibrés par la fluindione, chez qui un changement pourrait provoquer des risques hémorragiques ou thromboemboliques potentiellement graves. Les patients traités depuis moins de six mois doivent faire preuve de vigilance et contacter leur médecin si une insuffisance rénale (ou l’aggravation d’une insuffisance rénale préexistante), des anomalies cutanées de type allergique (œdème local, démangeaison, eczéma, rougeur généralisée…), une gêne respiratoire, de la fièvre ou tout autre symptôme inhabituel apparaissent. Une fiche d’information à remettre aux patients est disponible sur le site de l’ANSM (ansm.sante.fr).
Par ailleurs, l’Agence a décidé de contre-indiquer l’utilisation de tous les antivitamines K chez la femme enceinte, à l’exception de celles porteuses d’une valve cardiaque mécanique présentant un risque élevé de thrombose, auxquelles l’héparine ne peut être prescrite. Le risque tératogène, fœtotoxique et néonatal des AVK est réel : avortement spontané, mort in utero, malformations de la face, du squelette et du cerveau, retard de croissance et hémorragies. Par conséquent, les femmes sous AVK en âge de procréer doivent utiliser une contraception efficace. Un changement de traitement sera envisagé en cas de grossesse ou de désir de grossesse. Si l’AVK est pris pendant la grossesse, un diagnostic prénatal spécialisé et un suivi particulier seront mis en place, avec substitution par l’héparine à partir de la 36e semaine d’aménorrhée. §
- Comptoir officinal : optimiser l’espace sans sacrifier la relation patient
- Reishi, shiitaké, maitaké : la poussée des champignons médicinaux
- Budget de la sécu 2026 : quelles mesures concernent les pharmaciens ?
- Cancers féminins : des voies de traitements prometteuses
- Vitamine A Blache 15 000 UI/g : un remplaçant pour Vitamine A Dulcis